“Power plant” without DNA
environmentdinoflagellatesmitochondriageneticsparasitism
2 views - 1 viewers (visible to dev)
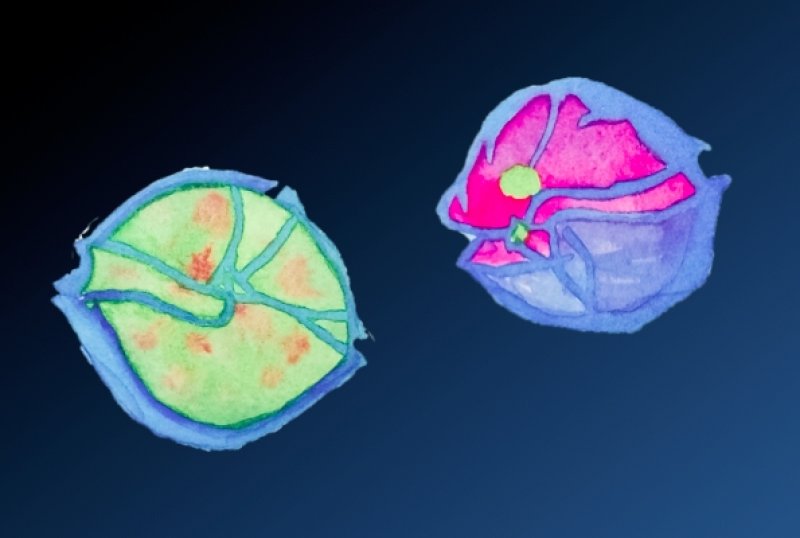
Watercolor image of a healthy dinoflagellate Alexandrium (left) and one affected by Amoebophrya (right), (c) Yameng Lu
Algae from the group of dinoflagellates have organized their genetic material in an unusal way The cells of most living things have special structures that are responsible for energy production. These so-called mitochondria usually have their own genome, in addition to that in the nucleus. Uwe John of the Alfred Wegener Institute (AWI) and his colleagues have now uncovered a hitherto unique exception in a single-celled parasite. The mitochondria of the dinoflagellate Amoebophrya ceratii seem to function properly even without their own genetic material, reports the team in the journal Science Advances. Dinoflagellates make up a large part of the plankton in the seas. About half of the approximately two thousand known species practice photosynthesis like plants, others live predatory or, depending on the offer, switch between different diets. And finally, this versatile algae group also has parasites in their ranks. With such a team, the team around Uwe John has now taken a look into the genome - and experienced a surprise. The researchers have found their study object within the cells of other dinoflagellates of the genus Alexandrium. This includes several species that tend to form toxic algal blooms in mass developments. Whole carpets from these unicellular organisms sometimes drift in the water and produce the nerve poison saxitoxin, which is also dangerous for humans. But there are parasites that can stem such algal blooms. These include a species called Amoebophrya ceratii, which was the focus of the current study. "These unicellular organisms swim through the water as so-called dinospores until they find their host," explains Uwe John. When the time comes, they attach themselves to their victim, penetrate into this and eat it from the inside up. They are getting bigger and bigger and form a stage with many cell nuclei. Like a worm, it finally crawls out of the dead host and breaks into 200 to 400 new dinosaur spines. Such a cycle of infection lasts only three to four days and can massively affect the Alexandrium populations. The team has sequenced the genome of the Giftalgen conqueror, which consists of about 100 million base pairs. That's very little for a dinoflagellate. Now, a small genome for a parasite is nothing special. Many followers of this lifestyle do not produce all the metabolites necessary for survival themselves, but use their hosts. This makes them dependent on these, but can also do without many genes. But Amoebophrya ceratii did not follow this path. "In this species, almost all metabolic processes work so that they should be able to cope on their own," says Uwe John. And it does that with a much smaller genome than any other dinoflagellate. It has driven this reduction particularly far in that part of the genome that lies outside the cell nucleus. In plants and algae, DNA is found not only in the mitochondria but also in the plastids that they need for photosynthesis. Their genome is generally quite small with dinoflagellates and consists of only 14 genes. Amoebophrya ceratii, however, seems to have completely abolished the plastids and, with one exception, their genes. Even more spectacular is the austerity program that the parasite has imposed on its mitochondria. In his relationship, there are still three genes in the DNA of these small cell power plants. Amoebophrya ceratii has apparently saved the entire mitochondrial genome. Despite all the meticulous search work, the team found no trace of it. Two genes have apparently disappeared, the third, cytochrome c oxidase 1 (COX1 or COI), has migrated into the nucleus. "That really surprised me," says Uwe John, "because so far no other oxygen-breathing creature is known that does not have its own genetic material in its mitochondria." This austerity could be handy if the parasites have to quickly create many new dinosaur spores. "It may be more effective to regulate all processes via the nucleus," says Uwe John. "So probably the resources of the host can be used in the best possible way." However, nothing would be gained if the energy supply collapsed. But the danger does not seem to exist: The mitochondria work well in all stages of life and allow the dinosaurs on host search even a rapid swim. "These parasites have probably found their own way to generate energy," says Uwe John. "They require only part of the five known protein complexes that are found throughout the mitochondria of humans and all animals to produce energy." The researchers hope that these findings will help to better understand the evolution of dinoflagellates and their relatives as a whole. That would also be interesting because the kinship of these algae also includes other parasites and the causative agents of diseases such as malaria. In addition, the results could provide new insights into the history of mitochondria and plastids. Both were originally independent creatures that were swallowed by other unicellular organisms from time immemorial and lived on in them as so-called endosymbionts. Over time, they have shrunk their genetic material and have become the service providers of cells that are no longer viable alone. This development, however, has taken Amoebophrya ceratii to extremes and has also deprived its endosymbionts of the remnants of their genetic autonomy.

Watercolor image of a healthy dinoflagellate Alexandrium (top right), one of Amoebophrya infested (left) and the worm-shaped parasite that breaks through the cell wall of the host (bottom right), (c) Yameng Lu
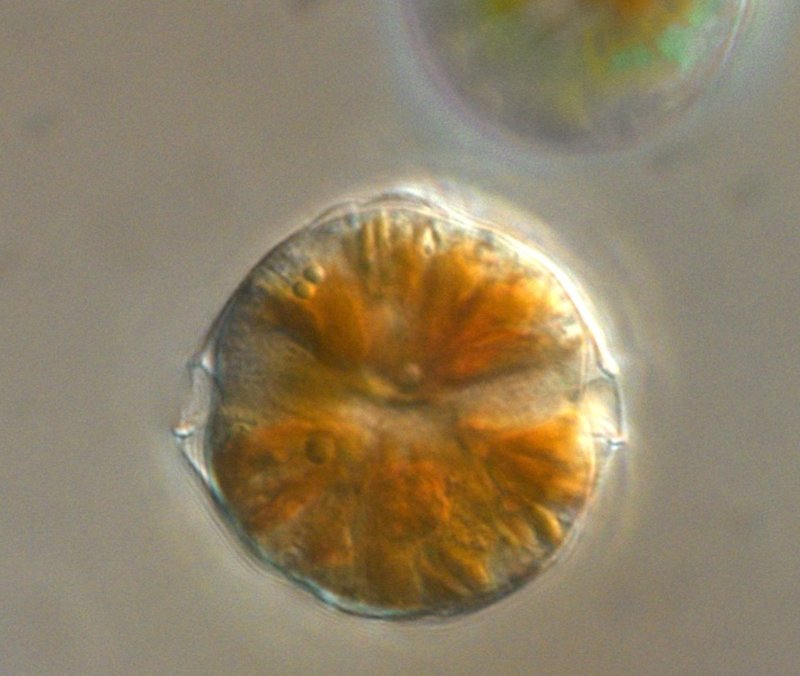
A healthy dinoflagellate of the genus Alexandrium, (c) Yameng Lu
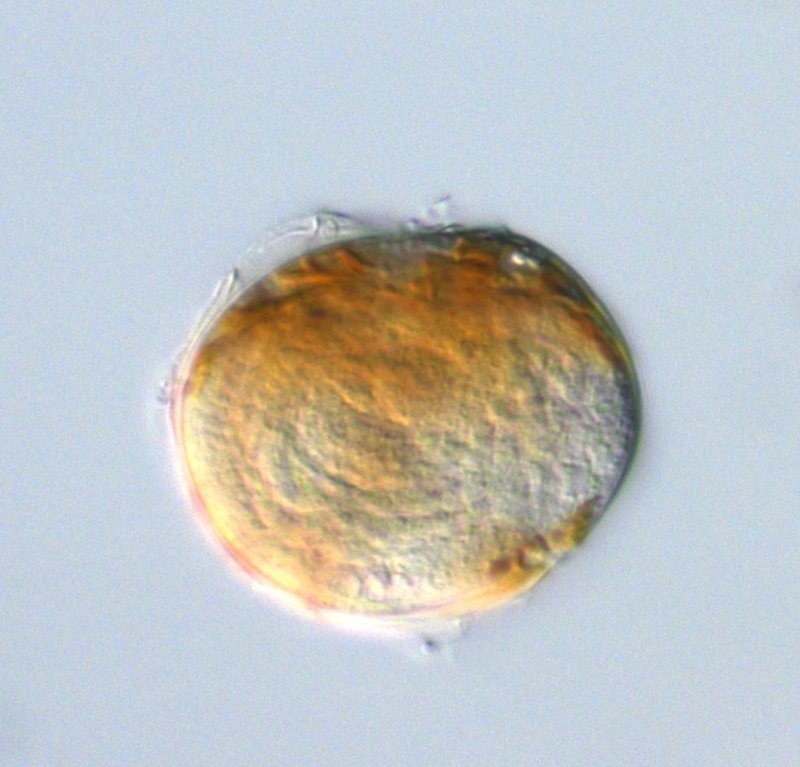
Alexandrium infested by Amoebophrya, (c) Yameng Lu